Dr. Julio D. Vorobioff
Profesor Asociado de Medicina, Universidad Nacional de Rosario. Rosario – Argentina
Palabras claves. Cirrosis, hipertensión portal, várices esofágicas.
Resumen
La hemorragia digestiva por ruptura de várices esofágicas es una complicación grave, y de elevado riesgo para la vida del paciente con cirrosis hepática. El avance del conocimiento fisiopatológico y la experiencia de numerosos estudios clínicos permiten proponer un esquema terapéutico que ha resultado en una significativa reducción en las cifras de mortalidad (~15-20% en los centros de referencia). El tratamiento incluye la reposición de volemia, la administración de antibióticos, de drogas vasoactivas y la hemostasia endoscópica (preferentemente ligaduras). En el 15-20% de los pacientes que fracasan a este esquema inicial puede intentarse una segunda instancia endoscópica (paciente estable o sangrado leve) o bien, en casos más graves, recurrir al taponamiento con sonda balón como “puente” hacia un tratamiento más definitivo (TIPS). Otra opción para el sangrado refractario es la utilización de stents metálicos auto-expandibles, de acción más prolongada (hasta 2 semanas) que la sonda balón. Todas estas actitudes requieren de una adecuada infraestructura y de recursos humanos altamente calificados, disponibles en centros dotados de la adecuada complejidad y que hacen del manejo médico del episodio de sangrado variceal una tarea multidisciplinaria.
Abstract
Acute bleeding from oesophageal varices is an important cause of morbidity and mortality in cirrhotic patients. Advances in both portal hipertensión pathophysiology knowledge and results of controlled clinical trials have significantly contributed in standardizing treatment and in reducing mortality (~15-20% in specialized centers). Treatment options include volumen reposition, antibiotics, vasoactive drugs, endoscopic variceal banding or sclerotherapy, balloon tamponade and TIPS. A new hemostatic device (fully covered self-expandable metallic stent) is useful in those cases in which balloon tamponade is considered, as it is more effective and safer for the temporary control of bleeding. The acute variceal bleeding episode requires a multidisciplinary approach, at referral centers, where most of these resources and trained medical staff should be available.
La hemorragia digestiva por ruptura de várices esófago-gástricas es la complicación más grave y mórbida de la cirrosis hepática, y registra una mortalidad que oscila entre el 15 y el 20%.1-4 Es importante destacar que la mortalidad asociada al sangrado variceal es la que se registra dentro de las 6 semanas posteriores al episodio índice y que sólo un 8-10% de los pacientes fallecen por sangrado incontenible.5 Las otras causas de óbito durante este período son el resangrado, las infecciones y las complicaciones propias de la cirrosis.1 Debe considerarse, además, que el sangrado variceal es responsable del 70-80% de las hemorragias digestivas altas en los pacientes cirróticos y que a lo largo de su historia natural, un 30-35% de estos pacientes cirróticos sangrará por várices esófago-gástricas.6
Medidas generales
El sangrado variceal agudo debe ser tratado en una Unidad de Cuidados Intensivos, por un equipo médico experimentado, que incluya personal de enfermería capacitado, hepatólogos clínicos, endoscopistas, radiólogos intervencionistas y cirujanos.7 La carencia de esta compleja infraestructura sugiere la inmediata derivación del paciente.
Los aspectos generales del tratamiento están orientados a corregir la hipovolemia y prevenir las complicaciones asociadas al sangrado (infecciones, descompensación hepática, insuficiencia renal). La resucitación inicial tiene como objetivo principal mantener el metabolismo aeróbico, asegurando una oferta tisular de O2 apropiada.8 Debe asegurarse la vía aérea, particularmente en presencia de encefalopatía porto-sistémica, debido al riesgo de bronco-aspiración, que está incrementado durante los procedimientos endoscópicos. Deberé procederse a la intubación ante la menor duda acerca de la seguridad de la vía aérea.
Es importante disponer de una vía periférica y otra central. La corrección de la volemia debe ser precoz, con expansores plasmáticos, intentando mantener una presión arterial sistólica de ~100 mmHg. La hipotensión prolongada predispone a infecciones, al desarrollo de insuficiencia renal y al deterioro de la función hepática, circunstancias que a su vez, condicionan un mayor riesgo de resangrado y muerte.9 Se requiere cautela en cuanto al volumen a administrar, debido a que la sobre expansión puede causar un rebote en la presión portal, con potencial riesgo de resangrado.10-12 La administración de concentrado de glóbulos rojos con una actitud restrictiva ha demostrado ser de beneficio en pacientes cirróticos Child A y B.13 En consecuencia, un objetivo razonable es mantener la hemoglobina entre 7-9 g/L, con excepciones razonables (sangrado activo, pacientes con enfermedad cardiovascular). Si bien no constituye una indicación formal, la administración de plaquetas puede considerarse en pacientes con ≤ 40.000 plaquetas/mL. No existen suficientes evidencias para aconsejar la administración rutinaria de Factor VII recombinante (rFVIIa) en la hemorragia variceal.7, 14
La encefalopatía porto-sistémica (EPS) es frecuentemente desencadenada por el sangrado gastrointestinal. Su tratamiento surge de las guías-recomendaciones de AASLD/EASL,7, 15 que sugieren evaluar/prevenir alteraciones del estado de conciencia, identificar y corregir los factores precipitantes y comenzar el tratamiento empírico.15 Este debe sostenerse en la administración de lactulosa, en una dosis inicial de 25 mL c/12 horas, hasta provocar 2-3 evacuaciones intestinales diarias. Logrado este objetivo, debe indicarse una dosis de mantenimiento que permita registrar un ritmo evacuatorio similar al mencionado. Como efectos adversos de la sobre dosificación de lactulosa se han descripto deshidratación, hipernatremia, daño renal agudo e incluso EPS. La administración continua de lactulosa, con carácter profiláctico para la EPS, no está aconsejada una vez resuelto el factor desencadenante (hemorragia) y superado el episodio de EPS.15
La injuria renal aguda (AKI en inglés) es otra de las complicaciones que pueden asociarse al sangrado variceal. Sus orígenes subyacen en la hipovolemia, las infecciones bacterianas y eventualmente, en la acción nefrotóxica de algunos fármacos. Se ha observado insuficiencia renal en ~11% de los pacientes aunque en un 40% de los casos es de carácter transitorio. La mortalidad observada en pacientes con injuria renal (55%) es significativamente superior a la de aquellos sin daño renal (3%). Además, en aquellos casos en que la injuria es persistente la mortalidad se eleva al 83%.7, 9
Como parámetros predictivos de injuria renal se ha identificado al score de Child-Pugh, la presencia de shock hipovolémico, el número de unidades de concentrado de glóbulos rojos administrados y la cifra basal de plaquetas. Las recomendaciones preventivas en estas circunstancias aconsejan la remoción de toda droga potencialmente nefrotóxica, una adecuada expansión de la volemia, el reconocimiento y el tratamiento precoz de las infecciones y, en determinados pacientes, la administración precoz de vasoconstrictores.7
Prevención y tratamiento de las infecciones bacterianas.
El escenario del sangrado variceal está íntimamente asociado al capítulo de las infecciones bacterianas. En efecto, en ausencia de profilaxis antibiótica alrededor de un 20% de los pacientes están infectados en el momento de la admisión y hasta un 50% desarrolla infección durante la internación.16 Esta elevada incidencia obedece a la particular predisposición que presentan los cirróticos a los procesos infecciosos: disfunción de la inmunidad innata y adaptativa, incremento en la permeabilidad intestinal y niveles patológicos de translocación bacteriana.17 Además, el sangrado digestivo alto, la insuficiencia hepática, el bajo contenido proteico en líquido ascítico y episodio/s previo/s de peritonitis bacteriana espontanea (PBE) son parámetros predictivos de riesgo para desarrollar infecciones.
La mayoría de estos procesos se presenta contemporáneamente a la hemorragia índice (5-7 días). Los más frecuentes son: bacteriemia (19-56%), PBE (19-37%), infecciones urinarias (12-34%) y neumonías (12-19%).18-19 Las infecciones incrementan la mortalidad relacionada al sangrado variceal18-19 e influyen negativamente en el control del sangrado y en la prevención del re-sangrado.20, 21 Durante las infecciones se han descripto alteraciones de la hemostasis, tales como la producción de heparinoides endógenos y la liberación de citoquinas, que alteran la función plaquetaria, aumentan la fibrinólisis e incrementan el consumo de factores de la coagulación.22 Además, simultáneamente puede observarse un aumento de la presión portal.20 Diversos estudios meta-analíticos han demostrado una significativa reducción en las tasas de infección bacteriana, de resangrado y de mortalidad con la profilaxis antibiótica.16, 18, 20 En consecuencia, las guías de la reunión de Baveno V recomendaron la iniciación precoz de antibioticoterapia profiláctica, con una duración de 5-7 días en todos los pacientes.23 El antibiótico de elección fue la norfloxacina oral [400 mg, 2 v/día, vía oral (de ser posible)]. Para un subgrupo de pacientes con infección reciente por gérmenes resistentes a quinolonas, o en aquellos que estuvieren recibiendo quinolonas con carácter profiláctico o en los que tuvieren “cirrosis avanzada” [ascitis, ictericia (bilirrubina > 3 mg/dL), EPS o malnutrición/desnutrición] se sugiere la administración de cefalosporinas de tercera generación.23
Las conclusiones fueron básicamente similares en el reciente Baveno VI. Sin embargo, y debido a que los riesgos de infección bacteriana y mortalidad son bajos en pacientes Child-Pugh A, se aconsejó la realización de estudios prospectivos antes de recomendar la no administración de antibióticos profilácticos en este grupo de pacientes.7 Cada centro debe analizar los riesgos individuales en cada paciente y la/s patente/s de susceptibilidad antimicrobiana local en la elección del antibiótico a utilizar en la hemorragia variceal. Si estas medidas se implementan correctamente, es probable que las quinolonas sean desplazadas de la primera línea profiláctica en la mayoría de los centros. La ceftriaxona (1 g c/24hs) debe considerarse en pacientes con cirrosis avanzada, en ámbitos hospitalarios con elevada tasa de resistencia bacteriana a quinolonas y en pacientes que reciben profilaxis previa con esta drogas.7
Medidas específicas.
Drogas vasoactivas.
Los vasoconstrictores esplácnicos constituyen la primera línea farmacológica específica para el tratamiento del sangrado variceal. Las terlipresina, la somatostatina y el octreotide son los vasoactivos actualmente disponibles. Poseen la capacidad de inducir, directa o indirectamente, vasoconstricción esplácnica y en consecuencia, una reducción del influjo sanguíneo arterial esplácnico y del flujo venoso porto-colateral. A su vez, la disminución del flujo porto-colateral induce un efecto hipotensor en este territorio venoso, del cual las várices esófago-gástricas son parte. La hemostasia variceal se ve favorecida por este efecto hipotensor.
La terlipresina es un análogo sintético de la vasopresina que tras ser administrada libera vasopresina en forma lenta a la circulación. Posee mayor vida media y menor incidencia de efectos adversos que la vasopresina. Se administra por vía E.V., en dosis iniciales de 2 mg c/4 hs., tras un bolo inicial de la misma concentración. Esta dosis puede mantenerse por hasta 5 días, tal cual se recomendó inicialmente. No obstante, una vez controlado el episodio hemorrágico la dosis puede reducirse a 1 mg c/4-6 hs, lográndose un efecto hemostático de hasta el 80%. Un meta-análisis basado en 7 estudios controlados demostró que la terlipresina reduce la falla para el control del sangrado (RR=0,66; 95% CI: 0,55 a 0,93) y que, comparada con otras drogas vasoactivas, mejora la sobrevida (RR=0,66; 95% CI: 0,49 a 0,88).7, 14, 24-26 Los efectos adversos son básicamente cardiovasculares: isquemia en las extremidades, arritmias, hipertensión arterial e insuficiencia cardíaca izquierda, por lo que es trascendente pesquisar las causas predisponentes a estas complicaciones. Finalmente, la terlipresina puede causar hiponatremia, particularmente en aquellos pacientes cirróticos con enfermedad hepática menos avanzada y Na sérico basal cercano a valores normales.28, 29
La somatostatina es un péptido natural, con acciones diversas sobre el sistema endócrino. Su efecto vasoconstrictor, indirecto, deriva de su rol inhibitorio sobre péptidos vasodilatadores esplácnicos. Su vida media de ~3 minutos y en consecuencia debe administrarse como infusión continua, endovenosa. La dosis recomendada es de 250 μg/hora, precedida por un bolo inicial de 250 μg. Sin embargo, en casos de sangrado activo, la administración de 500 μg/hora ha demostrado una mayor eficacia hemostática, debido a un mayor efecto hipotensor portal.7, 14, 30-32
El octreotide es un análogo sintético de la somatostatina con una vida media de ~2 horas y que puede administrarse por vía endovenosa o subcutánea. La dosis de infusión es de 25-50 μg/E.V./hora, precedida de un bolo de 50 μg. Su efecto hipotensor portal pudiera verse atenuado debido a una rápida desensibilización a la droga.33 La hiperglicemia es el efecto adverso más frecuente (~15%) durante la administración de somatostatina y octreotide.
Ante la sospecha del origen variceal del sangrado los fármacos vasoconstrictores deben administrarse precozmente. La administración temprana, previa al estudio endoscópico, ha demostrado beneficiosa en esa circunstancia.34, 35
La correcta utilización de drogas vasoactivas se asocia a una menor mortalidad, a menos requerimiento tranfusional, a un mayor control del sangrado y a una estadía hospitalaria más corta.36 Además, no se han observado diferencias significativas entre estos parámetros al comparar la utilización de distintos fármacos y no se observaron diferencias significativas entre los distintos fármacos.37
La terlipressina pudiera ser de elección en los sangrantes con hipotensión arterial y /o sindrome hepato-renal mientras que la somatostatina/octreotide serían los adecuados para pacientes hipertensos o con riesgo potencial de enfermedad coronaria y/o vascular periférica.7
Tratamiento endoscópico.
El estudio endoscópico es el más preciso para identificar la causa de sangrado digestivo alto y debe ser realizado a la mayor brevedad posible. Si existen alteraciones en el estado de conciencia, por la presencia de EPS u otra circunstancia, el paciente deberá ser intubado para minimizar el riesgo de bronco-aspiración. La endoscopía debe practicarse dentro de las 12 horas del ingreso, aunque puede admitirse cierto grado de flexibilidad si el paciente presenta estabilidad hemodinámica. En consecuencia, la disponibilidad de endoscopistas durante las 24 horas de los 7 días de la semana es parte elemental del capital de recursos humanos e infraestructura exigibles al centro que admite y trata estos pacientes.7, 38 La calidad del estudio endoscópico puede afectarse por la presencia de sangre, coágulos y/o líquido en el tracto digestivo superior. La administración de pro-quinéticos puede obviar estas dificultades y, de no haber contraindicaciones (prolongación del intervalo QT en el ECG), la infusión E.V. de eritromicina (250 mg, 30-120 minutos previos al estudio) ha demostrado ser útil en este escenario.7, 39
La terapia endoscópica (esclerosis o ligaduras) permite un control inicial del sangrado en alrededor del 85-95% de los casos. Diversos estudios demuestran que la ligadura es altamente hemostática y tiene una menor incidencia de efectos colaterales que la escleroterapia. En consecuencia, constituyen la terapia endoscópica de primera elección en el sangrado agudo variceal. No obstante, si existen dificultades técnicas para aplicar bandas, puede recurrirse a la esclerosis. La combinación de tratamiento farmacológico y endoscópico es significativamente superior a cualquiera de ellos aplicado en forma individual y debe considerarse como la primera opción terapéutica en el sangrado variceal.7, 40
Várices gástricas
Las várices gástricas están presentes en hasta un 15-20% de los pacientes cirróticos y en un porcentaje algo mayor (10-30%) en las obstrucciones extra-hepáticas. No obstante su menor frecuencia de sangrado, la situación clínica es más grave que en la hemorragia por várices esofágicas, con mayor mortalidad y mayor propensión al resangrado.7, 41
Las implicancias terapéuticas y pronósticas del sangrado difieren de acuerdo al tipo de várice considerado. Las várices GOV1 (extensión de várices esofágicas en la curvatura menor gástrica) pueden ser tratadas con ligaduras endoscópicas o mediante la inyección de adhesivos tisulares (N-butyl-2-cianoacrilato) mientras que las várices GOV2 (extensión de várices esofágicas en el fundus gástrico) la recomendación terapéutica es la inyección de adhesivos tisulares.
Las várices gástricas aisladas (IGV) son protrusiones vasculares sin conexión con las várices esofágicas, pudiendo estar localizadas en el fundus (IGV1) o en cualquier otro lugar del estómago (IGV2). En cualquiera de estas 2 circunstancias la inyección de adhesivos tisulares constituye la actitud terapéutica indicada.
Al margen de las especificidades del tratamiento endoscópico, todas las demás indicaciones pertinentes al tratamiento del sangrado variceal esofágico tienen absoluta vigencia en el caso de las várices gástricas.7, 40, 42
El fracaso del tratamiento convencional
La creciente implementación de las medidas terapéuticas descriptas ha permitido aumentar el control del sangrado y reducir la mortalidad de manera significativa.1-4 No obstante, hasta un 20% de los pacientes pueden ser refractarios a estas iniciativas y esa situación se asocia a elevada mortalidad.40
Los criterios de fracaso terapéutico están definidos en las recomendaciones elaboradas en Baveno IV/V/VI (Tabla 1)43-45 y las opciones aplicables a dicha circunstancia son: repetición del estudio endoscópico con intento terapéutico y/o la inserción de un TIPS con prótesis recubierta. Otra opción válida es la colocación de una sonda-balón, hasta la adopción de una terapéutica definitiva.40
Tabla 1. Criterios de fracaso para falla en el control del sangrado
El taponamiento realizado con doble sonda-balón de Sengstaken-Blakemore es eficazmente hemostático y controla hasta un 80% de los fracasos del tratamiento convencional. Se recomienda, aunque no de manera taxativa, limitar su utilización a 24 horas. Además del daño mucoso esofágico por uso prolongado, se han descripto complicaciones asociados a su incorrecta colocación, ruptura esofágica y neumonía por aspiración.7, 46, 47
La inserción de un TIPS (shunt intra-hepático porto-sistémico trans-yugular) como actitud terapéutica “de rescate” es otra alternativa válida. Sin embargo, se asocia a elevada mortalidad (35%) y deterioro de la función hepática, particularmente en pacientes con enfermedad más avanzada que son, paradójicamente, quienes tienen mayores índices de falla de control de sangrado y por ende, necesidad de una terapia “de rescate”. 7, 48, 49
Debido a las limitaciones del TIPS y del taponamiento, una alternativa terapéutica para el sangrado refractario es el uso de stents metálicos auto-expandibles (SMAU).7, 50-52 La mayor experiencia con este dispositivo incluye al denominado SX-Ella Danis stent. Se trata de un stent recubierto, auto-expandible y extraíble, específicamente diseñado para el sangrado de origen variceal. Tiene 13,5 cm de longitud y 2,5 cm de diámetro, lo que permite un taponamiento satisfactorio del esófago inferior. Se coloca mediante una guía introducida por vía endoscópica, aunque puede hacérselo sin ayuda endoscópica o fluoroscópica. Puede permanecer en el esófago entre 7 y 14 días y ser retirado con el endoscopio. La complicación más frecuente es la migración al estómago, pero su diseño permite recapturarlo y volverlo al esófago.50-52 Las tasas de hemostasia son elevadas, aunque también la mortalidad. Esto se debe a que habitualmente los pacientes en quienes se recurre al stent tienen contraindicación para el TIPS por insuficiencia hepática avanzada y sus co-morbilidades. A diferencia del TIPS, con el stent no hay mayor riesgo de deterioro de la insuficiencia hepática.50-52
El TIPS como terapia primaria
La notable mejoría en las cifras de sobrevida relacionadas al sangrado variceal1-4 no es extensiva a los pacientes de alto riesgo (15-25%) en quienes la tasa de mortalidad permanece elevada (~30%).53
Para estos pacientes el TIPS como terapia “de rescate” es muy eficaz en lo hemostático (~90%), aunque la mortalidad a las 6 semanas es elevada (~50%).54 A esa altura de los acontecimientos es habitual que el paciente haya experimentado varios episodios de sangrado con sus correspondientes intentos terapéuticos endoscópicos, que esté infectado, con diverso grado de insuficiencia renal además de trastornos hemodinámicos y alteraciones en la coagulación. Finalmente, fallece por falla multiorgánica. Una decisión terapéutica más temprana, electiva, basada en parámetros clínicos claramente definibles pudiera evitar el progreso del deterioro y mejorar la sobrevida.
La inserción temprana de un TIPS a determinados pacientes (“de riesgo”) mejoraría el pronóstico?. En 2010 se publicó un estudio multinacional, controlado, cuyo objetivo fue evaluar específicamente este aspecto. El TIPS como tratamiento “temprano” (dentro de las 72 horas) fue indicado para pacientes de alto riesgo, así definidos por un score de Child-Pugh C (<14 puntos) o bien un score de Child-Pugh B con sangrado activo. El grupo control recibió terapéutica preventiva combinada (beta-bloqueantes + ligaduras endoscópicas). El TIPS mejoró el control del sangrado, disminuyó el resangrado y mejor la sobrevida al año respecto del grupo control (p<0.001 en todos los casos), sin observarse diferencias en la incidencia de PSE. Los autores sugieren que el tratamiento temprano con TIPS debiera ser parte formal del esquema terapéutico en pacientes de alto riesgo.55
Recientes estudios han demostrado similares resultados. No obstante, en la práctica diaria existen factores subjetivos relacionados a la definición endoscópica de sangrado activo y a la valoración del score de Child-Pugh. Otro aspecto considerable son las limitaciones de infraestructura y/o de recursos económicos para proceder a la colocación de un TIPS dentro de las 72 horas en la mayor parte de los centros en los que estos pacientes son admitidos.7, 56-58
El stent metálico auto-expandible como terapia primaria?
Ante el fracaso el tratamiento convencional y la no disponibilidad inmediata (o contraindicación) de otros procedimientos (ej. TIPS) la colocación de un SMAU sería una alternativa para controlar el sangrado. La posibilidad de permanecer colocado durante hasta 2 semanas otorgaría un margen temporal hasta acceder a otra opción terapéutica. El SMAU ha demostrado eficacia como terapia primaria en pacientes con elevado riesgo de falla en el control del sangrado y de resangrado. Además, podría ser una opción terapéutica al taponamiento con balón en el sangrado refractario, por su mayor tiempo de acción y la menor chance de generar efectos adversos.7, 52, 59
Parámetros pronósticos en el sangrado variceal
La gravedad implícita del episodio de sangrado y la heterogeneidad de la población afectada condicionan la evolución del cuadro. En consecuencia, se ha intentado establecer índices y analizar parámetros de valor predictivo que permitan una orientación más específica en relación al pronóstico y la terapéutica a seguir.
Los parámetros predictores de la falla en el control del sangrado y de la prevención del resangrado son varios, y algunos de ellos reflejan aspectos de la severidad de la hemorragia: várices con estigmas importantes, sangrado activo durante la endoscopía, hipotensión, shock hipovolémico, el grado de anemia y/o requerimiento transfusional. Además, pueden considerarse la presencia de insuficiencia renal, de infección bacteriana (comunitaria u hospitalaria) y/o carcinoma hepatocelular (HCC). Todos, de manera aislada o asociados, han sido identificados como predictores de mortalidad temprana.7, 60 Otros parámetros, tales como el score de Child-Pugh (reflejo de funcionalismo hepático) y el gradiente porto-sistémico (GPS) son considerados sólidos predictores de mortalidad a las 6 semanas.7, 60, 61
El score de Child-Pugh, la presión arterial sistólica y la etiología no alcohólica de la cirrosis;7, 62 el score de Child-Pugh, la creatinina sérica y la presencia de infección bacteriana7, 63 y la incorporación del MELD “calibrado”7, 64 también han demostrado tener valor pronóstico en relación a la mortalidad dentro de las 6 semanas. De acuerdo a opiniones consensuadas en la reciente reunión de Baveno (Baveno VI), la clase C de Child-Pugh, el score de MELD actualizado y la falla para alcanzar hemostasia primaria serían los más sólidos predictores de mortalidad a las 6 semanas.7
Resumen
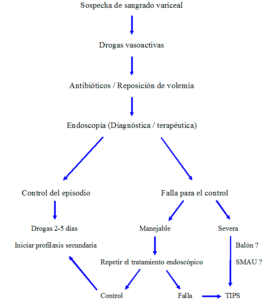
El tratamiento de la hemorragia por várices esofágicas en el paciente cirrótico ha experimentado notables progresos durante las últimas 3 décadas y estos avances se han traducido en una significativa reducción de la mortalidad asociada al episodio. La sobrevida no siempre es consecuencia directa del control del sangrado activo y de la prevención exitosa del resangrado. Si bien un 5-8% de los pacientes fallecen por sangrado incontrolable, la mayoría logra hemostasis. Más aún, alrededor del 30% de los pacientes detienen el sangrado de manera espontánea. Las causas más frecuentes de muerte incluyen la insuficiencia hepática, las infecciones y la falla renal. Todas ellas pueden presentarse, y de hecho con frecuencia lo hacen, una vez que el sangrado se ha detenido completamente. La observación de un esquema terapéutico adecuado en tiempo y en forma (Figura 1) sólo es factible en centros dotados de la infraestructura y los recursos humanos exigibles para esta instancia. Sólo así podrán obviarse al máximo los riesgos inherentes al sangrado y a la enfermedad hepática subyacente.
Figura 1. Tratamiento de la hemorragia por várices esofágicas.
Referencias
- D’Amico G, de Franchis R and a Cooperative Study Group. Upper digestive bleeding in cirrhosis. Post-therapeutic outcome and prognostic indicators. Hepatology 2003; 38: 599-612.
- Chalasani N, Kahi C, Francois F, Pinto A, Marathe A, Bini EJ, Pandya P, Sitaraman S, Shen J. Improved patient survival after acute variceal bleeding: a multicenter, cohort study. Am J Gastroenterol 2003; 98: 653-659.
- Carbonell N, Pauwels A, Serfaty L, Fourdan O, Lévy VG, Poupon R. Improved survival after variceal bleeding in patients with cirrhosis over the past two decades. Hepatology 2004; 40: 652-659.
- Stokkeland K, Brandt L, Ekbom A, Hultkrantz R. Improved prognosis for patients hospitalized with esophageal varices in Sweden 1969-2002. Hepatology 2006; 43: 500-505.
- Pagliaro L, de Franchis E. Where were we? A summary of the issues where consensus was reached at Baveno I. En: de Franchis R, ed. Portal Hypertension II. Proceedings of the Second Baveno International Consensus Workshop on Definitions, Methodology and Therapeutic Strategies. Oxford, Blackwell Science; 1996: 1-9.
- Pagliaro L, D’Amico G, Pasta L, Politi F, Vizzini G, Traina M, Madonia S, Luca A, Guerrera D., Puleo A, D’Antoni A. Portal hypertension in cirrhosis: Natural history. En: Bosch J & Groszmann RJ, eds. Portal Hypertension: Pathophysiology and Treatment. Oxford, Blackwell Scientific Publications; 1994: 72-92.
- García-Pagán JC, Aabbken L, Bureau C, Gralnek I, Ho Lo G, Nevens F, O’Beirne J, Tandon P, Villanueva C, Thabut D. Consensus statements: Management of the acute bleeding episode. En: En: de Franchis R, ed. Portal Hypertension VI. Proceedings of the Sixth Baveno Consensus Workshop: Stratifying Risk and Individualizing Care. Springer International Publishing Switzerland; 2016: 281-285.
- Burroughs AK. General management of the cirrhotic patient with acute variceal bleeding. En: de Franchis R, ed. Portal Hypertension ΙΙΙ. Proceedings of the Third Baveno International Consensus Workshop on Definitions, Methodology and Therapeutic Strategies. Oxford, Blackwell Science; 2001: 135-142.
- Cárdenas A, Gines P, Uriz J, Bessa X, Salmerón JM, Mas A, Ortega R, Calahorra B, De Las Heras D, Bosch J, Arroyo V, Rodés J. Renal failure after upper gastrointestinal bleeding in cirrhosis: incidence, clinical course, predictive factors and short-term prognosis. Hepatology 2001; 34: 671-676.
- Kravetz D, Sikuler E, Groszmann RJ. Splanchnic and systemic hemodynamics in portal hypertensive rats during hemorrhage and blood volume restitution. Gastroenterology 1986; 90: 1232-1240.
- McCormick PA, Jenkins SA, McIntyre N et al. Why portal hypertensive varices bleed and bleed: a hypothesis. Gut 1995; 36: 100-103.
- Castañeda B, Debernardi-Venon W, Bandi JC et al. The role of portal pressure in the severity of bleeding in portal hypertensive rats. Hepatology 2000; 31: 581-586.
- Villanueva C, Colomo A, Bosch A, Concepción M, Hernandez-Gea V, Aracil C, Graupera I, Poca M, Alvarez-Urturi C, Gordillo J, Guarner-Argente C, Santaló M, Muñiz E, Guarner C. Transfusion strategies for acute upper gastrointestinal bleeding. N Engl J Med 2013; 368: 11-21.
- Tripathi D, Stanley AJ, Hayes PC, Patch D, Millson C, Mehrzad H, Austin A, Ferguson JW, Olliff SP, Hudson M, Christie JM. UK guidelines on the management of variceal haemorrhage in cirrhotic patients. Gut 2015; 64: 1680-1704.
- Vilstrup H, Amodio P, Bajaj J, Cordoba J, Ferenci P, Mullen KD, Weissenborn K, Wong P. Hepatic encephalopathy in chronic liver disease: 2014 Practice Guideline by the American Association for the Study of Liver Diseases and the European Association for the Study of the Liver. Hepatology 2014; 60: 715-735.
- Chávez-Tapia NC, Barrientos-Gutiérrez T, Tellez-Ávila FI, Soares-Weiser K, Uribe M. Antibiotic prophylaxis for cirrhotic patients with upper gastrointestinal bleeding. Cochrane Database Syst Rev 2010; 9: CD002907.
- Jalan R, Fernández J, Wiest R, Schnabl B, Moreau R, Angeli P, Stadlbauer V, Gustot T, Bernardi M, Canton R, Albillos A, Lammert F, Wilmer A, Mookerjee R, Vila J, García-Martínez R, Wendosn J, Such J, Cordoba J, Sanyal A, García-Tsao G, Arroyo V, Burroughs A, Gines P. Bacterial infections in cirrhosis: a position statement based on the EASL special conference 2013. J Hepatol 2014; 60: 1310-1324.
- Bernard B, Grange JD, Khac EN, Amiot X, Opolon P, Poynard T. Antibiotic prophylaxis for the prevention of bacterial infections in cirrhotic patients with gastrointestinal bleeding: a meta-analysis. Hepatology 1999; 29: 1655-1661.
- Pauwels A, Mostefa-Kara N, Debenes B, Degoutte E, Levy VG. Systemic antibiotic prophylaxis after gastrointestinal hemorrhage in cirrhotic patients with a high risk of infection. Hepatology 1996; 24: 802-806.
- Goulis J, Armonis A, Patch D, Sabin C, Greenslade L, Burroughs AK. Bacterial infection is independently associated with failure to control bleeding in cirrhotic patients with gastrointestinal hemorrhage. Hepatology 1998; 27: 1207-1212.
- Hou MC, Lin HC, Liu TT, Kuo BI, Lee FY, Chang FY, Lee SD. Antibiotic prophylaxis after endoscopic therapy prevents rebleeding in acute variceal hemorrhage: a randomized trial. Hepatology 2004; 39: 746-753.
- Tripodi A, Mannucci PM. The coagulopathy of chronic liver disease. N Engl J Med 2011; 365: 147-156.
- Laine L, Abid S, Albillos A, Kamath PS, Vinel JP, García-Pagán JC. Treatment of acute bleeding. En: de Franchis R, ed. Portal Hypertension V. Proceedings of the Fifth Baveno International Consensus Workshop. Oxford, Wiley-Blackwell; 2006: 103-118.
- Chang TT, Lee FY, Tsai YT, Lai KH, Chao Y, Hsia HC, Lin HC, Wang SS, Lee SD, Lo KJ. A randomized controlled study of low-dose and high-dose terlipressin in the control of acute oesophageal variceal haemorrhage. J Gastroenterol Hepatol 1991; 6: 481-484.
- Ioannou GN, Doust J, Rockey DC. Terlipressin in acute oesophageal variceal haemorrhage. Cochrane Database Syst Rev 2003; 1: CD002147.
- Azam Z, Hamid S, Jafri W, Salih M, Abbas Z, Abid S, et al. Short course adjuvant terlipressin in acute variceal bleeding: arandomized double blind dummy controlled trial. J Hepatol 2012; 56: 819-824.
- Lo GH, Chen WC, Wang HM, Lin CK, Chan HH, Tsai WL et al. Low-dose terlipressin plus banding ligation versus low-dose terlipressin alone in the prevention of very early rebleeding of oesophageal varices. Gut 2009; 58: 1275-1280.
- Solá E, Lens S, Guevara M, Martin-Llahi M, Fagundes C, Pereira G, Pavesi M, Fernández J, González-Abraldes J, Escorsell A, Mas A, Bosch J, Arroyo V, Ginés P. Hyponatremiain patients treated with terlipressin for severe gastrointestinal bleeding due to portal hypertension. Hepatology 2010; 52: 1783-1790.
- Yim SY, Seo YS, Jung CH, Kim TH, Kim ES, Keum B, Kim JH,An H,Yim HJ, Yeon JE, Jeen YT, Lee HS, Chun HJ, Byun KS, Um SH, Kim CD, Ryu HS. Risk factors for developing hyponatremia during terlipressin treatment: a retrospective analyses in variceal bleeding. J Clin Gastroenterol 2015; 49: 607-612.
- Bosch J, Kravetz D, Rodés J. Effects of somatostatin on hepatic and systemic hemodynamics in patients with cirrhosis of the liver: comparison with vasopressin. Gastroenterology 1981; 80: 518-525.
- Cirera I, Feu F, Luca A, Garcia-Pagan JC, Fernández M, Escorsell A, Bosch J,Rodés J. Effects of bolus injections and continuous infusions of somatostatin and placebo in patients with cirrhosis: a double-blind hemodynamic investigation. Hepatology 1995; 22: 106-111.
- Moitinho E, Planas R, Bañares R, Albillos A, Ruiz-del-Arbol L, Gálvez C, BoschJ; Variceal Bleeding Study Group. Multicenter randomized controlled trial comparing different schedules of somatostatin in the treatment of acute variceal bleeding. J Hepatol 2001; 35: 712-718.
- Escorsell A, Bandi JC, Andreu V, Moitinho E, Garcia-Pagan JC, Bosch J, Rodés J. Desensitization to the effects of intravenous octreotide in cirrhotic patients with portal hypertension. Gastroenterology 2001; 120: 161-169.
- Levacher S, Letoumelin P, Pateron D, Blaise M, Lapandry C, Pourriat JL. Early administration of terlipressin plus glyceryl trinitrate to control active upper gastrointestinal bleeding in cirrhotic patients. Lancet 1995; 346: 865-868.
- Avgerinos A, Nevens F, Raptis S, Fevery J. (1997) Early administration of somatostatin and effi cacy of sclerotherapy in acute oesophageal variceal bleeds: the European Acute Bleeding Oesophageal Variceal Episodes (ABOVE) randomised trial. Lancet 1997; 350: 1495-1499.
- Wells M, Chande N, Adams P, Beaton M, Levstik M, Boyce E, Mrkobrada M. Meta-analysis: vasoactive medications for the management of acute variceal bleeds. Aliment Pharmacol Ther 2012; 35: 1267-1278.
- Seo YS, Park SY, Kim MY, Kim JH, Park JY, Yim HJ, Jang BK,Kim HS,Hahn T, Kim BI, Heo J, An H, Tak WY, Baik SK, Han KH, Hwang JS, Park SH, Cho M, Um SH. Lack of difference among terlipressin, somatostatin, and octreotide in the control of acute gastroesophageal variceal hemorrhage. Hepatology 2014; 60: 954-63.
- Cheung J, Soo I, Bastiampillai1 R , Zhu Q , Ma M. Urgent vs. non-urgent endoscopy in stable acute variceal bleeding. Am J Gastroenterol 2009; 104: 1125-1129.
- Theivanayagam S, Lim RG, Cobell WJ, Gowda JT, Matteson ML, Choudhary A, Bechtold ML. Administration of erythromycin before endoscopy in upper gastrointestinal bleeding: a meta-analysis of randomized controlled trials. Saudi J Gastroenterol 2013; 19: 205-210.
- de Franchis R. Revising consensus in portal hypertension: report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension. J Hepatol 2010; 53: 762-768.
- Sarin SK, Lahoti D, Saxena SP, Murthy NS, Makwana UK. Prevalence, classification and natural history of gastric varices: a long-term follow-up study in 568 portal hypertension patients. Hepatology 1992; 16: 1343-1349.
- Garcia-Tsao G, Sanyal AJ, Grace ND, Carey W. Prevention and management of gastroesophageal varices and variceal hemorrhage in cirrhosis. Hepatology 2007; 46: 922-938.
- Burroughs A, Cales P, Kravetz D, Riggio O, Thabut D, van Buuren HR, Kamath PS. Definition of key events-Last attempt ?. En: de Franchis R, ed. Portal Hypertension IV. Proceedings of the Fourth Baveno International Consensus Workshop on Methodology of Diagnosis and Treatment. Blackwell Publishing. Oxford 2006: 11-40.
- Burroughs AK, Thabut D, D’Amico G, Brendtsen F, Bureau C, Cales P, Escorsell A. Failure to control bleeding and failure to control rebleeding. En: de Franchis R, ed. Portal Hypertension V. Proceedings of the Fifth Baveno International Consensus Workshop. Wiley-Blackwell. Oxford; 2011: 77-90.
- Villanueva C, O’Beirne J, Bureau C, Thabut D. A la carte treatment of acute variceal bleeding. En: de Franchis R, ed. Portal Hypertension VI. Proceedings of the Sixth Baveno Consensus Workshop: Stratifying Risk and Individualizing Care. Springer International Publishing Switzerland; 2016: 261-279.
- Panes J, Teres J, Bosch J, Rodés J. Efficacy of baloon tamponade in treatment of bleeding gastric and esophageal varices: results in 151 consecutive episodes. Dig Dis Sci 1988; 33: 454-459.
- Chong C. Esophageal rupture due to Sengstaken-Blakemore tube misplacement. World J Gastroenterol 2005; 11: 6563-6565.
- Azoulay D, Castaing D, Majno P, Saliba F, Ichai P, Smail A, Delvart V,Danaoui M,Samuel D, Bismuth H. Salvage transjugular intrahepatic portosystemic shunt for uncontrolled variceal bleeding in patients with decompensated cirrhosis. J Hepatol 2001; 35: 590-597.
- Roessle M. TIPS: 25 years later. J Hepatol 2013; 59: 1081-1093.
- Wright G, Lewis H, Hogan B, Burroughs A, Patch D, O’Beirne J. A self-expanding metal stent for complicated variceal hemorrhage: experience at a single center. Gastrointest Endosc 2010; 71: 71-78.
- Dechene A, El Fouly AH, Bechmann LP, Jochum C, Saner FH, Gerken G, Canbay A. Acute management of refractory variceal bleeding in liver cirrhosis by self-expanding metal stents. Digestion 2012; 85: 185-191.
- Escorsell A, Pavel O, Cárdenas A, Morillas R, Llop E, Villanueva C, García-Pagán JC,Bosch J.Variceal Bleeding Study Group. Esophageal balloon tamponade versus esophageal stent in controlling acute refractory: A multicenter randomized, controlled trial. Hepatology 2016; 63: 1957-1967.
- Bosch J, Thabut D, Albillos A, Carbonell N, Spicak J, Massard J et al. Recombinant factor VIIa for variceal bleeding in patients with advanced cirrhosis: a randomized, controlled trial. Hepatology 2008; 47: 1604–1614.
- Vangelli M, Patch D, Burroughs AK. Salvage TIPS for uncontrolled variceal bleeding. J Hepatol 2002; 37: 177-181.
- García-Pagán JC, Caca K, Bureau C, Laleman W, Appenrodt B, Luca A et al. Early use of TIPS in patients with cirrhosis and variceal bleeding. N Engl J Med 2010; 362: 2370-2379.
- Garcia-Pagan JC, Di Pascoli M, Caca K, Laleman W, Bureau C, Appenrodt B et al. Use of early-TIPS for high-risk variceal bleeding: results of a post-RCT surveillance study. J Hepatol 2013; 58: 45-50
- Rudler M, Rousseau G, Thabut D. Salvage transjugular intrahepatic portosystemic shunt followed by early transplantation in patients with Child C14-15 cirrhosis and refractory variceal bleeding: a strategy improving survival. Transpl Int 2013; 26: E50–E51.
- Thabut D, Remy A, Carbonell N, Causse X, Coelho J, Cadranel JF, Cervoni JP, Bramli S, Archambeaud I, Ah-soune P, Ehrhard F, Pariente A, Bureau C, Dupuychaffray JP, Rostain F, Skinazi F, Vergniol J, Vitte RI, Pelletier AL, Henrion J, Guillygomarch A, Combet S, Pauwels S. Prospective observational study of portal-hypertensive bleeding in 914 cirrhotic patients in France (CHOC study): high proportion of high-risk patients but limited access to TIPS. Hepatology 2014; 60: 1199A.
- Zakaria MS, Hamza IM, Mohey MA, Hubamnn RG. The first Egyptian experience using new self-expandable metal stents in acute esophageal variceal bleeding: Pilot study. Saudi J Gastroenterol 2013; 19: 177-181.
- D’Amico G, Garcia-Tsao G, Pagliaro L. Natural history and prognostic indicators of survival in cirrhosis: a systematic review of 118 studies. J Hepatol 2006; 44: 217-231.
- Monescillo A, Martínez-Lagares F, Ruiz-del-Arbol L, Sierra A, Guevara C, Jiménez E. Influence of portal hypertension and its early decompression by TIPS placement on the outcome of variceal bleeding. Hepatology 2004; 40: 793-801.
- Abraldes JG, Villanueva C, Bañares R, Aracil C, Catalina MV, Garci A-Pagán JC,BoschJ; Spanish Cooperative Group for Portal Hypertension and Variceal Bleeding. Hepatic venous pressure gradient and prognosis in patients with acute variceal bleeding treated with pharmacologic and endoscopic therapy. J Hepatol 2008; 48: 229-236.
- Augustin S, Muntaner L, Altamirano JT, González A, Saperas E, Dot J, Abu-Suboh M,Armengol JR,Malagelada JR, Esteban R, Guardia J, Genescà J. Predicting early mortality after acute variceal hemorrhage based on classification and regression tree analysis. Clin Gastroenterol Hepatol 2009; 7: 1347-1354.
- Reverter E, Tandon P, Augustin S, Turon F, Casu S, Bastiampillai R, Keough A, Llop E, González A, Seijo S, Berzigotti A, Ma M, Genescà J, Bosch J, García-Pagán JC, Abraldes JG. A MELD-based model to determine risk of mortality among patients with acute variceal bleeding. Gastroenterology 2014; 146: 412-419.
Correspondencia: Dr. Julio D. Vorobioff
Dirección: Morrison 8750. Rosario, Santa Fé, Argentina.
Tel: 0341 4514087
Cel: 0341 156 620331
Correo electrónico: vorodiez@fibertel.com.ar, jdvorobioff@hotmail.com
 Revista ACTA Órgano Oficial de SAGE
Revista ACTA Órgano Oficial de SAGE